Internationale Studie macht Stammzelltransplantationen sicherer
„Diese Therapie kann Stammzelltransplantationen deutlich sicherer machen. Wir hoffen deshalb sehr, dass sie schon bald in der Europäischen Union zugelassen wird“, sagt Prof. Dr. Robert Zeiser, Leiter der Abteilung für Tumorimmunologie und Immunregulation der Klinik für Innere Medizin I am Universitätsklinikum Freiburg. Er hat gemeinsam mit Prof. Dr. Nikolas von Bubnoff, Direktor der Klinik für Hämatologie und Onkologie am Universitätsklinikum Schleswig-Holstein – Campus Lübeck, die Studie mit 105 Studienzentren in 22 Ländern koordiniert und geleitet. GVHD führt unkontrolliert zu Gewebeschäden von Darm, Haut und Leber. In einem Fünftel der Fälle führt die Entzündungsreaktion zum Tod der Patient*innen durch Infektion oder gravierende Organschäden. „Die Zulassung von Ruxolitinib in den USA ist die erste Zulassung eines Medikaments zur Behandlung der Kortison refraktären Transplantat-gegen-Wirt-Reaktion weltweit“, sagt von Bubnoff.
Therapieerfolg deutlich höher als bisher
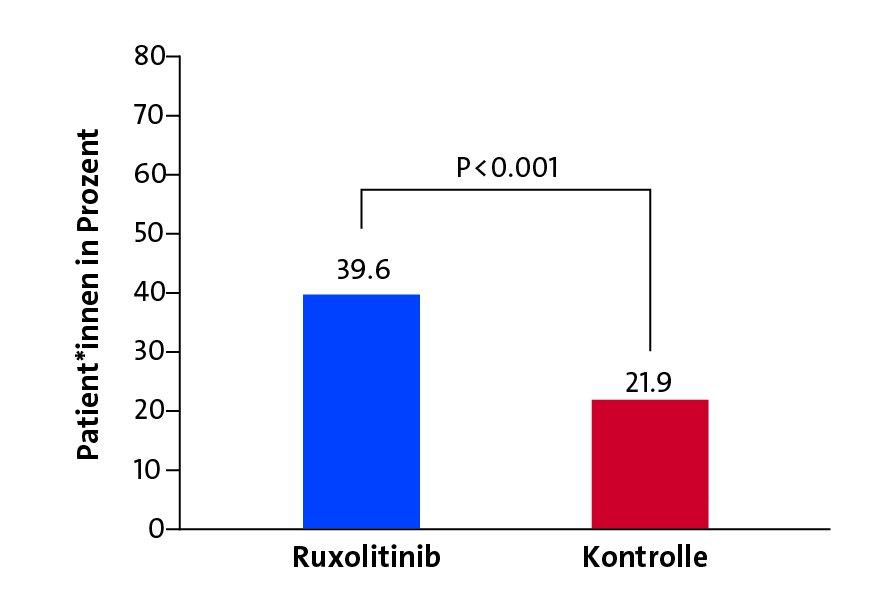
Die in der REACH2-Studie behandelten Patient*innen hatten alle nach einer Stammzelltransplantation eine Transplantat-gegen-Wirt-Reaktion entwickelt, die sich mit Kortisonpräparaten nicht stoppen ließ und akut lebensbedrohlich wurde. Die Hälfte der Betroffenen erhielt Ruxolitinib, die andere Hälfte die bisherige Standardtherapie. Nach 28 Tagen Therapie zeigten 62 Prozent der Patient*innen unter der neuen Therapie einen vollständigen oder teilweisen Rückgang der GVHD. Unter der Standardtherapie waren es 39 Prozent. Nach rund zwei Monaten war die Kontrolle der Immunreaktion unter Ruxolitinib mit fast 40 Prozent sogar fast doppelt so hoch wie unter der Standardtherapie mit 22 Prozent. „Die Behandlung mit Ruxolitinib führt damit zu einem dauerhaften Behandlungserfolg“, freut sich Zeiser.
Forschung von der Petrischale bis zu den Patient*innen
In vorangegangen Arbeiten konnten die Forschungsgruppen um Zeiser und von Bubnoff zunächst in Zell- und Tierstudien zeigen, dass Ruxolitinib die Aktivierung und gegenseitige Verstärkung der transplantierten Immunzellen bremst. Diese Vorarbeiten waren die Basis für die spätere Anwendung beim Menschen. Die jetzige Phase-III-Studie REACH2 dürfte eine wesentliche Rolle bei der Zulassung auch in Europa spielen. „Die Studienergebnisse bestätigen unsere jahrelange Arbeit zur GVHD und liefern eine wichtige Grundlage für die Zulassung“, sagt von Bubnoff. Die REACH2-Studie wurde von Novartis Pharma durchgeführt.
Universitätsklinikum Freiburg
Hugstetter Strasse 49
79106 Freiburg
Telefon: +49 (761) 270-0
Telefax: +49 (761) 270-2020
http://www.uniklinik-freiburg.de
Telefon: +49 (761) 270-34010
E-Mail: robert.zeiser@uniklinik-freiburg.de
Universitätsklinikum Schleswig-Holstein
Telefon: +49 (451) 500-44151
Fax: +49 (451) 500-44154
E-Mail: Nikolas.vonBubnoff@uksh.de
![]()



