Neuer Ansatzpunkt für Entwicklung medikamentöser Behandlung von Adipositas und Typ-2-Diabetes
Medikamente mit gleichzeitiger Wirkung an den Rezeptoren für das Glukagon-ähnliche Peptid-1 (GLP-1) und das glukoseabhängige insulinotrope Polypeptid (GIP) gelten als vielversprechende neue Wirkstoffe zur Behandlung von Übergewicht und Typ-2 Diabetes. Jetzt haben Forschende herausgefunden wie GIP das Körpergewicht senkt. GIP ist ein Hormon, welches im Verdauungstrakt gebildet wird. Nach der Nahrungsaufnahme stimuliert es die Ausschüttung von Insulin und senkt so den Blutzuckerspiegel. Das Hormon hat aber auch einen Effekt auf die Appetitregulation. Doch über welche Mechanismen und Organe GIP auf das Körpergewicht wirkt, ist noch nicht bekannt. Zudem war bislang unklar, ob der GIP-Rezeptor für die Senkung des Körpergewichtes aktiviert oder blockiert werden muss und welche Rolle das Gehirn bei der Wirkung von GIP spielt. „Ziel unserer Untersuchungen war es herauszufinden, ob dem GIP-Rezeptor im Gehirn eine besondere Bedeutung bei der Wirksamkeit von GIP zukommt“, erläutert Erst-Autorin Qian Zhang vom Institut für Diabetes und Adipositas am Helmholtz Zentrum München.
GIP senkt das Körpergewicht durch eine über das Gehirn vermittelte Hemmung der Nahrungsaufnahme
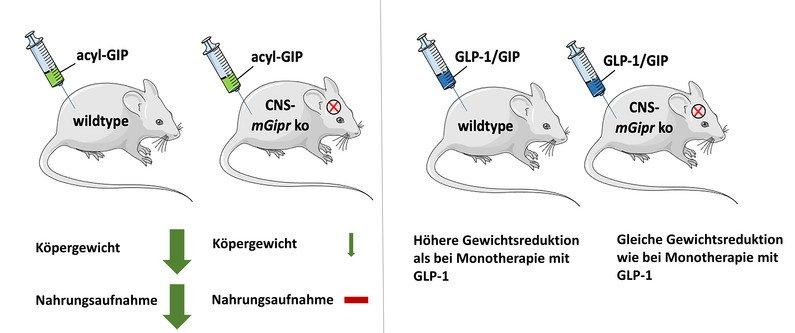
Die Forschenden konnten zeigen, dass die Gabe von GIP bei Wildtyp-Mäusen das Körpergewicht und die Nahrungsaufnahme senkt, nicht aber bei Mäusen, welchen der GIP-Rezeptor im zentralen Nervensystem fehlt.
Wirkt das Hormon auf bestimmte Bereich im Gehirn? Um diese Frage zu beantworten, untersuchten die Forschenden die Hirnaktivität von Mäusen, bei denen durch Ernährung ein Diabetes ausgelöst wurde. „Dabei zeigte sich nach Gabe von GIP eine erhöhte neuronale Aktivität in Bereichen des Hypothalamus, die mit der Kontrolle des Appetits verbunden sind“, berichtet Christian Wolfrum von der ETH Zürich. Die Wissenschaftlerinnen und Wissenschaftler schließen daraus, dass die zentrale Regulierung der Nahrungsaufnahme durch GIP auch die Aktivierung wichtiger Neuronen im Hypothalamus einschließt.
Neue Ansatzpunkte für die Entwicklung einer medikamentösen Behandlung von Adipositas und Typ-2-Diabetes
Die neuen Erkenntnisse sind auch für die Entwicklung einer medikamentösen Behandlung von Adipositas und Typ-2-Diabetes von Bedeutung. Forschende des Helmholtz Zentrums München haben gemeinsam mit der Indiana University einen neuen therapeutischen Ansatz für Typ-2-Diabetes entwickelt. Sie kombinierten Hormone in einem einzigen Molekül, das gleichermaßen an den Rezeptoren der Hormone GLP-1 und GIP wirkt. Dieser duale Agonist senkt das Gewicht und verbessert die Blutzuckerwerte1. GLP-1/GIP Co-Agonisten befinden sich bereits in klinischen Studien der Phase 3. In klinischen Studien zeigte sich, dass GLP-1/GIP im Vergleich zur der alleinigen Gabe von GLP-1 das Körpergewicht stärker reduzierte.
„Diese deutlichen Unterschiede bei der Gewichtsabnahme sind jedoch nicht bei Mäusen zu sehen, denen der GIP-Rezeptor im zentralen Nervensystem fehlt“, sagt Timo Müller, Letztautor der neuen Studie und Leiter des Instituts für Diabetes und Adipositas am Helmholtz Zentrum München. Hier reduzieren der GLP-1/GIP Co-Agonist und die Gabe von GLP-1 das Körpergewicht gleich stark. „Unsere Arbeiten zeigen zum ersten Mal, dass der GLP-1/GIP-Dual-Agonist den GIP-Rezeptor im Gehirn benötigt, um das Körpergewicht und die Nahrungsaufnahme zu senken“, erläutert Timo Müller. „Diese Erkenntnisse können dazu beitragen, neuartige Wirkstofftargets zu entwickeln, die die Signalgebung und -wirkung des GIP-Rezeptors verbessern. Das könnte helfen, die metabolischen Vorteile einer Behandlung mit GIP und GLP-1/GIP weiter zu steigern.“
Original-Publikation:
Qian Zhang et al.: The glucose-dependent insulinotropic polypeptide (GIP) regulates body weight and food intake via CNS-GIPR signaling. Cell Metabolism. DOI: https://doi.org/…
1Original-Publikation:
Finan, B. et al. (2013). Novel Unimolecular Dual-Incretins Maximize Metabolic Benefits in Rodents, Monkeys, and Humans. Science Translational Medicine, DOI: 10.1126/scitranslmed.3007218
Das Helmholtz Zentrum München verfolgt als Deutsches Forschungszentrum für Gesundheit und Umwelt das Ziel, personalisierte Medizin für die Diagnose, Therapie und Prävention weit verbreiteter Volkskrankheiten wie Diabetes mellitus und Lungenerkrankungen zu entwickeln. Dafür untersucht es das Zusammenwirken von Genetik, Umweltfaktoren und Lebensstil. Der Hauptsitz des Zentrums liegt in Neuherberg im Norden Münchens. Das Helmholtz Zentrum München beschäftigt rund 2.300 Mitarbeiter und ist Mitglied der Helmholtz-Gemeinschaft, der 18 naturwissenschaftlich-technische und medizinisch-biologische Forschungszentren mit rund 37.000 Beschäftigten angehören. www.helmholtz-muenchen.de
Das Deutsche Zentrum für Diabetesforschung (DZD) e.V. ist eines der sechs Deutschen Zentren der Gesundheitsforschung. Es bündelt Experten auf dem Gebiet der Diabetesforschung und verzahnt Grundlagenforschung, Epidemiologie und klinische Anwendung. Ziel des DZD ist es, über einen neuartigen, integrativen Forschungsansatz einen wesentlichen Beitrag zur erfolgreichen, maßgeschneiderten Prävention, Diagnose und Therapie des Diabetes mellitus zu leisten. Mitglieder des Verbunds sind das Helmholtz Zentrum München – Deutsches Forschungszentrum für Gesundheit und Umwelt, das Deutsche Diabetes-Zentrum DDZ in Düsseldorf, das Deutsche Institut für Ernährungsforschung DIfE in Potsdam-Rehbrücke, das Institut für Diabetesforschung und Metabolische Erkrankungen des Helmholtz Zentrum München an der Eberhard-Karls-Universität Tübingen und das Paul-Langerhans-Institut Dresden des Helmholtz Zentrum München am Universitätsklinikum Carl Gustav Carus der TU Dresden, assoziierte Partner an den Universitäten in Heidelberg, Köln, Leipzig, Lübeck und München sowie weitere Projektpartner. Weitere Informationen: www.dzd-ev.de
Deutsches Zentrum für Diabetesforschung e.V.
Ingolstädter Landstrasse 1
85764 Neuherberg
Telefon: +49 (89) 3187-2086
http://www.dzd-ev.de
Fachlicher Ansprechpartner
Telefon: +49 (89) 3187-43278
Presse- und Öffentlichkeitsarbeit
Telefon: +49 (89) 3187-3971
E-Mail: niesing@dzd-ev.de
![]()