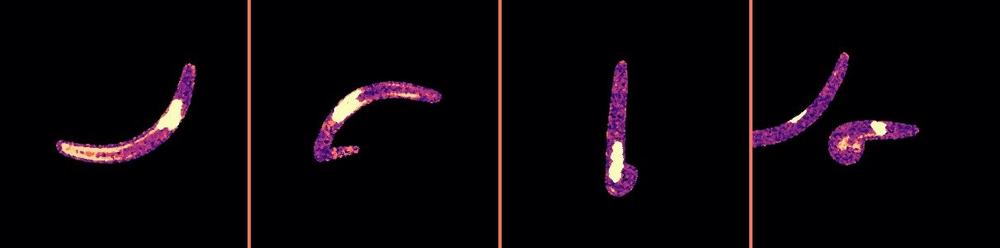
Außer Form geraten: Form- und Bewegungsschwäche von Malaria-Parasiten verhindert Übertragung
Der Parasit Plasmodium wird über einen Mückenstich in die Haut übertragen. In diesem Moment beginnt ein Wettrennen mit den Abwehrzellen auf dem Weg zu den feinen Blutgefäßen der Haut. Das Heidelberger Team zeigte bereits in vorangegangenen Arbeiten, dass sich die aus einer einzigen Zelle bestehenden Parasiten für ihre Größenverhältnisse sehr schnell bewegen – schneller als die Immunzellen – und sich mit Hilfe ihres molekularen Motors, der aus ähnlichen Proteinen aufgebaut ist wie menschliche Muskelzellen, durch das Labyrinth aus Hautzellen und Bindegewebsfasern schlängeln. Dabei hilft ihnen ihre einzigartige Form: Sie winden sich um die Blutgefäße und bohren sich hinein. Mit dem Blutstrom gelangen die Parasiten zur Leber, wo sie sich einnisten und den ersten Vermehrungszyklus im menschlichen Körper durchlaufen.
Die Bedeutung der Körperform untersuchte die Forschungsgruppe um Erstautorin Jessica Kehrer und Prof. Frischknecht mit Hilfe genetisch veränderter Parasiten. Die Forschenden entfernten ein Gen, das mutmaßlich mit der Zellform von Plasmodium zusammenhängt. Die veränderten Erreger entwickelten sich in der Mücke zunächst ganz normal – bis zum Eintritt in die Speicheldrüse, dem „Startblock" zum Sprint durch die menschliche Haut: In der Speicheldrüse der Mücke verloren sie ihre Form und rundeten sich von hinter her ab. Mit dieser nun tropfenförmigen oder abgerundeten Gestalt passte ein Großteil der Parasiten nicht mehr in den dünnen Speichelkanal im Stechrüssel der Mücke. Sie konnten während des Stiches nicht übertragen werden.
Gemeinsam mit Wissenschaftlerinnen und Wissenschaftlern aus dem Institut Pasteur, Paris, zeigte das Team außerdem, dass die wenigen verbliebenen schlanken Parasiten, die es bis in die Haut schafften, Schwierigkeiten hatten, sich durch die Haut zu schlängeln. Sie blieben zwischen Zellen stecken, verloren dabei sogar Teile ihres Körpers und gingen zugrunde. „Die Ergebnisse zeigen, dass das untersuchte Protein, das die Forscher Concavin nannten, eine wichtige Rolle in der Ausbreitung der Parasiten spielt", so Frischknecht.
Molekularer Motor muss präzise reguliert sein
Außerdem untersuchten die Forschenden Veränderungen im Motorprotein Myosin, das den Parasiten antreibt. Sie fanden heraus, dass die reversible Bindung von Phosphat, die sogenannte Phosphorylierung, an einer bestimmten Stelle des Myosins notwendig ist, damit das Motorprotein effizient arbeiten kann. Verhindert man die Phosphorylierung durch eine kleine genetische Veränderung, sind die Bewegungen der Parasiten in unterschiedlichen Stadien gestört. In der Folge vermehren sich die Parasiten im Blut langsamer, wahrscheinlich, weil sie schlechter in die roten Blutzellen eindringen können. In der lebenden Mücke kommen die veränderten Erreger kaum noch in die Speicheldrüse und sind dadurch bei der Übertragung durch einen Mückenstich weit weniger infektiös. „Das bedeutet: Die Parasiten schaffen es nicht mehr in die Startblöcke und können auch bei dieser Veränderung nicht ins Rennen geschickt werden", fasst Prof. Frischknecht zusammen.
Literatur
Kehrer J, Formaglio P, Muthinja JM, Weber S, Baltissen D, Lance C, Ripp J, Grech J, Meissner M, Funaya C, Amino R, Frischknecht F. Plasmodium sporozoite disintegration during skin passage limits malaria parasite transmission. EMBO Rep. 2022 Apr 11:e54719. doi: 10.15252/embr.202254719. Epub ahead of print. PMID: 35403820.
Ripp J, Smyrnakou X, Neuhoff M-T, Hentzschel F, Frischknecht F.
Phosphorylation of myosin A regulates gliding motility and is essential for Plasmodium transmission. EMBO Rep. 2022 May 04:e54857. doi.org/10.15252/embr.202254857. Epub ahead of print.
Universitätsklinikum und Medizinische Fakultät Heidelberg: Krankenversorgung, Forschung und Lehre von internationalem Rang
Das Universitätsklinikum Heidelberg (UKHD) ist eines der bedeutendsten medizinischen Zentren in Deutschland; die Medizinische Fakultät Heidelberg der Universität Heidelberg zählt zu den international renommierten biomedizinischen Forschungseinrichtungen in Europa. Gemeinsames Ziel ist die Entwicklung innovativer Diagnostik und Therapien sowie ihre rasche Umsetzung für den Patienten. Klinikum und Fakultät beschäftigen rund 14.000 Mitarbeiterinnen und Mitarbeiter und engagieren sich in Ausbildung und Qualifizierung. In mehr als 50 klinischen Fachabteilungen mit fast 2.000 Betten werden jährlich circa 84.000 Patienten voll- und teilstationär und mehr als 1.000.000 Patienten ambulant behandelt.
Gemeinsam mit dem Deutschen Krebsforschungszentrum (DKFZ) und der Deutschen Krebshilfe (DKH) hat das UKHD das erste Nationale Centrum für Tumorerkrankungen (NCT) in Heidelberg etabliert. Ziel ist die Versorgung auf höchstem Niveau als onkologisches Spitzenzentrum und der schnelle Transfer vielversprechender Ansätze aus der Krebsforschung in die Klinik. Zudem betreibt das UKHD gemeinsam mit dem DKFZ und der Universität Heidelberg das Hopp-Kindertumorzentrum Heidelberg (KiTZ), ein deutschlandweit einzigartiges Therapie- und Forschungszentrum für onkologische und hämatologische Erkrankungen im Kindes- und Jugendalter. Das Heidelberger Curriculum Medicinale (HeiCuMed) steht an der Spitze der medizinischen Ausbildungsgänge in Deutschland. Derzeit befinden sich an der Medizinischen Fakultät Heidelberg (MFHD) rund 4.000 angehende Ärztinnen und Ärzte in Studium und Promotion. www.klinikum-heidelberg.de
Universitätsklinikum Heidelberg
Im Neuenheimer Feld 672
69120 Heidelberg
Telefon: +49 (6221) 56-5052
Telefax: +49 (6221) 56-5999
http://www.klinikum.uni-heidelberg.de
Zentrum für Infektiologie – Abteilung Parasitologi
Telefon: +49 (6221) 56-6537
E-Mail: friedrich.frischknecht@med.uni-heidelberg.de
![]()