-
Globale UDI Implementierung mit der richtigen Strategie und UDI Datenmanagementsystem
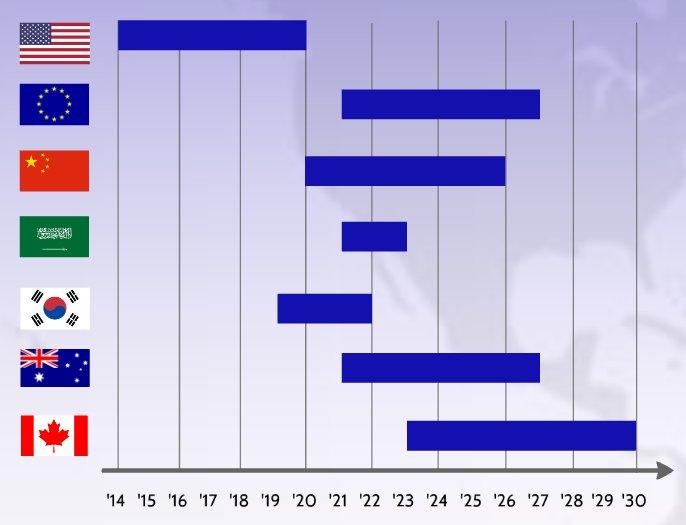
Die Umsetzung der globalen Medizinprodukte-Verordnungen rückt immer näher und bereits im Mai diesen Jahres (2021) müssen die ersten Medizinprodukte, welche auf dem europäischen Markt vertrieben werden, den Anforderungen der Medical Device Regulation (MDR 2017/745) und der In-vitro Diagnositic Regulation (IvDR 2017/ 746) der Europäischen Kommission entsprechen. Im Ergebnis soll jedes Medizinprodukt eine individuelle, nachverfolgbare Kennzeichnung (UDI) erhalten und in der zentralen europäischen Datenbank für Medizinprodukte EUDAMED erfasst werden, um einen höheren Patientenschutz und eine verbesserte Transparenz zu gewährleisten. Dieses weitumfassende Vorhaben hat wesentliche Folgen für sämtliche Medizinproduktehersteller und -vertreiber. Insbesondere international agierende Unternehmen müssen entsprechend den unterschiedlichen Absatzmärkten zahlreiche Fristen und Anforderungen beachten. Die oben gezeigte Abbildung präsentiert den globalen…
-
Webinar UDI EUDAMED 2021 (Webinar | Online)
Kostenloses Webinar: Globale UDI Implementierung mit der richtigen Strategie und UDI Datenmanagement System Die Einhaltung internationaler Anforderungen und Standards zur Gewährleistung der globalen UDI-Konformität stellt Medizinproduktehersteller vor eine riesige Herausforderung. Die sich ändernden Fristen und oft mehrdeutigen Richtlinien tragen zudem nicht dazu bei, sich Klarheit darüber zu verschaffen, was genau von einem verlangt wird. EUDAMED mag sich verzögert haben, aber ein erfolgreiches Stammdatenmanagement mit Blick auf die globale UDI-Konformität ist immer noch ein komplexes Vorhaben. Um die Einhaltung der aktualisierten Zeitvorgaben sicherzustellen ist eine effektive Stammdatenstrategie sowie der Aufbau und die Pflege eines UDI Datenmanagementsystems unerlässlich. Dieses sollte nicht nur in der Lage sein UDI-Daten zu pflegen und zu validieren,…
-
MDR / IVDR: Zeitplan – Änderungen – Auswirkungen
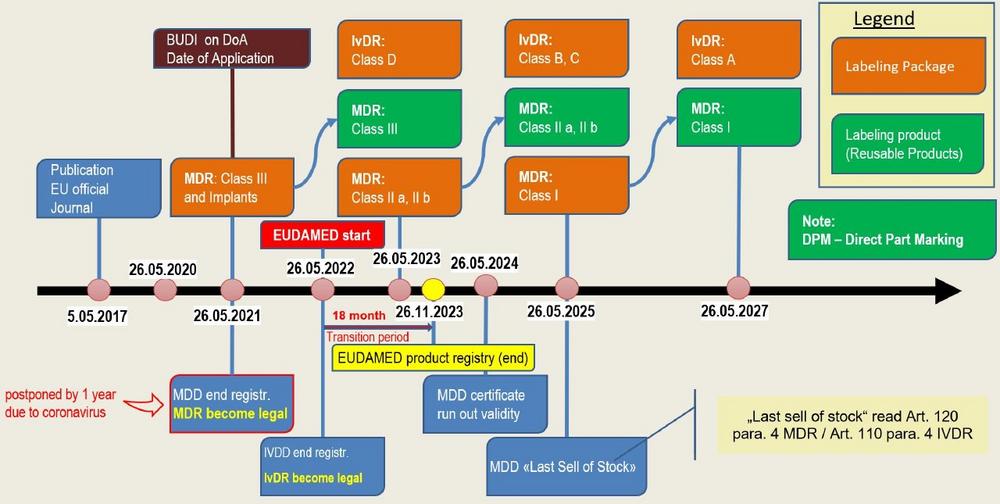
<p><strong>Was ist die MDR /IVDR</strong> <em>Gesetzgebung</em> Die neue europäische Medical Device Regulation (MDR 2017/745, EU-Medizinprodukte-Verordnung) und die In-vitro Diagnostic Regulation (IVDR 2017/746, EU-Verordnung über In-Vitro-Diagnostika) ersetzen die bestehenden Medizinprodukte-Richtlinien.</p> <p><strong> </strong></p> <ul> <ul> <li>die <strong>MDD 93/42/EWG </strong>und die<strong> AIMD 90/385/EWG </strong>werden zur<strong> MDR 2017/745 </strong></li> </ul> </ul> <ul> <ul> <li>die <strong>IVD 98/79/EG </strong>wird zur<strong> IVDR 2017/746 </strong></li> </ul> </ul> <p> </p> <p>Seit dem <strong>25.05.2017</strong> sind die EU-Verordnungen, die MDR und die IVDR, in Kraft getreten. Nach einer Verschiebung auf Grund der COVID-19 Pandemie ist nun neu die MDR ab dem <strong>26.05.2021</strong> anwendbar. Die Anwendbarkeit der IVDR wurde wie geplant auf dem <strong>26.05.2022</strong> belassen. <em>Ziel der MDR / IVDR</em> Ziel der neuen EU-Verordnungen ist es, die Patientensicherheit weiter zu verbessern und zu erhöhen. Dementsprechend sehen die wesentlichen…
-
Handlungsbedarf für Medizinproduktehersteller im Bereich UDI
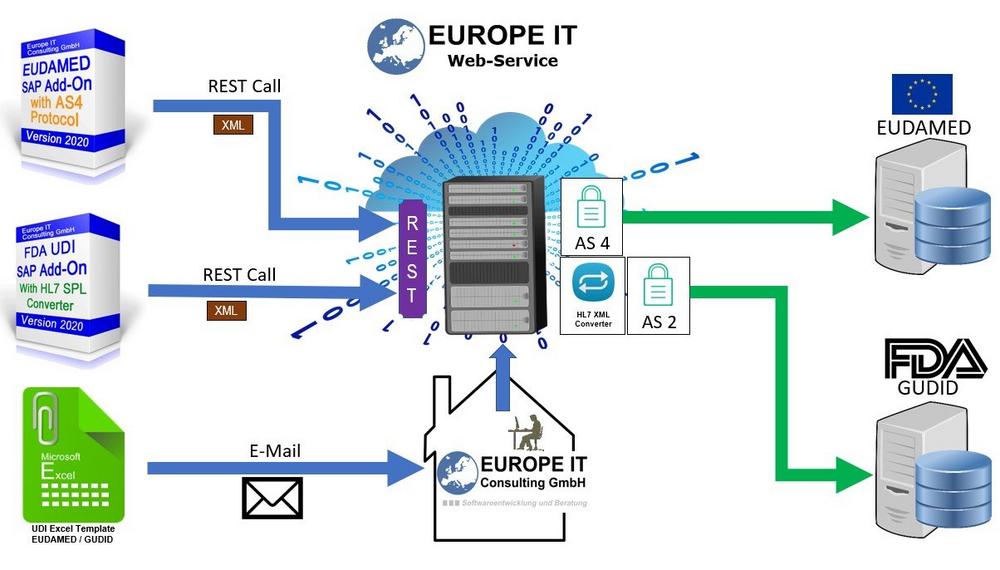
Was für Lebensmittel heute bereits gilt, wird auch für Medizinprodukte Realität. Die Rückverfolgbarkeit muss sichergestellt werden, mit dem übergeordneten Ziel, die Patientensicherheit zu optimieren. Die Vorbereitungen bei Medizinprodukteherstellern sollten auf höchsten Touren laufen und es besteht dringender Handlungsbedarf. Es bleibt zwar nicht mehr viel Zeit, aber es ist noch nicht zu spät. Im Zentrum dieser Umstellung stehen die Datenbanken der Food and Drug Administration (FDA) namens GUDID (Global Unique Device Identification Database) und diejenige der EU namens EUDAMED (European Database on Medical Devices). Beide verlangen eine einmalige Produktidentifikation, welche über das UDI-System (Unique Device Identification) gehandhabt wird. Alle Medizinprodukte müssen mit dieser einmaligen UDI-Produktidentifikation gekennzeichnet und auf die entsprechende Datenbank…