-
Application Lifecycle Management mit Link.IT!
Der SAP Solution Manager 7.2 in Verbindung mit Link.IT! bietet eine zeitgemäße und zukunftssichere Lösung, die sowohl Konzernen als auch mitteständischen Unternehmen eine skalierbare Plattform für das ganzheitliche Application Life Cycle Management und die agile Durchführung von Projekten bereitstellt. Problem Seit mehr als 25 Jahren sind Unternehmen in der Life Science Industrie gezwungen, ihre gxp relevanten Anwendungssysteme wie SAP zu validieren und IT Service Management Prozesse zu implementieren, die die Validität über den gesamten Lebenszyklus sicherstellen. Leitfäden wie ITIL und GAMP liefern hierzu den methodisches Rahmen und werden stetig angepasst und erweitert. Während aber der Trend zur Digitalisierung und Automatisierung bei den Geschäftsprozessen eine immer höhere Durchdringung mit Anwendungssystemen zur…
-
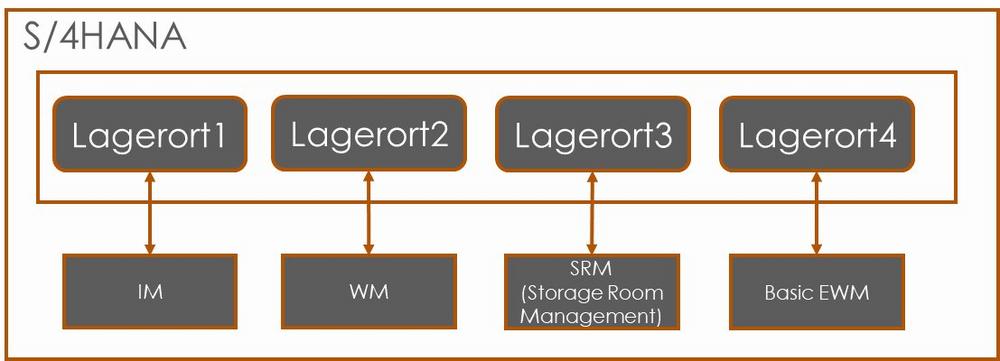
SAP WM wird zum Stock Room Management
SAP plant aktuell die Einstellung des LE-WM (Warehouse Management) Moduls zum Jahr 2025. In Zukunft wird das WM Modul jedoch durch das sogenannte Stock Room Management ersetzt, damit Unternehmen über das Jahr 2025 hinaus die klassischen WM Funktionen weiterhin verwenden können, ohne auf das Modul EWM umsteigen zu müssen. Neben der neuen Namensgebung von LE-WM zu Stockroom Management, wird SAP in Zukunft auch einige Funktionalitäten entfernen, welche bislang unter dem LE-WM Modul vorzufinden waren. Das Stock Room Management ist durch die SAP S/4HANA Enterprise Management Lizenz bereits abgedeckt. (SAP Note 2881166) Stock Room Management vs. Warehouse Management – welche Funktionen werden in Zukunft fehlen? Das Stock Room Management soll insbesondere…
-
Die neue EU Medical Device Regulation (MDR)
Nach verschiedenen Skandalen in den vergangenen Jahren mit defekten Medizinprodukten, sollte mit einer Überarbeitung der Medizinprodukterichtlinie (MDR), eine bessere Sicherheit von Medizinprodukten und deren Überwachung gewährleistet werden. Mit der Neufassung der Medizinprodukte Richtlinie kommen daher eine Vielzahl von Änderungen auf die Unternehmen zu. Die Verschiebung der Implementierung der EU Medical Device Regulation (MDR) um ein Jahr auf den 26.05.2021, gibt den Unternehmen nun ein zusätzliches Jahr Zeit zur Umsetzung, die gut genutzt sein will. Im Folgenden werden die wichtigsten Eckpunkte in Bezug auf Qualitätsmanagement und Software zusammengefasst sowie eine kleine Handlungsempfehlung zur Verfügung gestellt wie sich das zusätzliche Jahr optimal nutzen lässt. Qualitätsmanagement Je nach Risikoklasse standen Hersteller von Medizinprodukten schon vorher in…
-
IT Projekte im GxP regulierten Umfeld erfolgreich führen (Webinar | Online)
Das Arbeiten in Projekten ist im IT-Bereich Bestandteil des „Daily Business“ und wurde gerade im agilen Kontext zu einem entscheidenden Element unserer digitalisierten Wirtschaft. Der ausschließliche Betrieb eines Systems bedeutet Stillstand – es wird produziert, aber nicht optimiert oder verbessert. Projekte bedeuten Fortschritt, Änderungen, Optimierung und Verbesserungen und sind deswegen unverzichtbar für Unternehmen. „Wer aufhört, besser zu werden, hat aufgehört, gut zu sein.“(Philip Rosenthal, 1916-2001, Industrieller und Politiker) Die Entstehung neuer digitaler Technologien und die stetige Weiterentwicklung bestehender IT-Systeme führt zu einer steigenden Komplexität und Bedeutung von IT-Projekten und -Programmen und macht diese somit zu wichtigen strategischen Elementen des Unternehmenserfolgs. Laut der Capgemini Studie „IT-Trends 2020“ steht der Ausbau der…
-
Objektbasierte Validierung mit dem SAP Solution Manager
Die Validierung eines Systems wie SAP S4/HANA* ist kein Hexenwerk. Sie bedarf eines prozessorientierten Ansatzes mit einem stabilen Testkonzept und entsprechender Methodik zur Dokumentation. Die Wahl einer effektiven Methode zur Durchführung der Dokumentation reduziert den Aufwand drastisch und die Erfolgschancen, Dokumentation nachhaltig zu betreiben. Klassische, dokumentenbasierte Lösungen – State of the art oder nicht mehr zeitgemäß? Entsprechende Lösungen zur Verwaltung von Dokumenten – die auch die regulatorischen Anforderungen an ein DMS System erfüllen – sind vorhanden, bieten aber unterschiedliche Vor- und Nachteile und sind mit weiteren Kosten verbunden. Wurde sich für eine entsprechende DMS Lösung zur Dokumentation der Validierung entschlossen, werden Anforderungen und Spezifikationen, Testpläne und Testreports sowie Risikobewertungen als…
-
Nur noch 4 Monate bis zum Inkrafttreten der neuen Medizinprodukte Verordnung!
Am 26. Mai 2020 tritt die neue Medizinprodukteverordnung in Kraft mit einer Vielzahl an nicht unerheblichen Verschärfungen für die Industrie. Insbesondere durch neue Klassifizierungsregeln und verschärfte Kontrollen und Anforderungen nicht nur an die Unternehmen selbst als auch an die kontrollierenden Organe, besteht dringender Handlungsbedarf für Unternehmen, die sich bisher noch nicht oder nicht ausreichend damit befasst haben. Erfahrungsgemäß setzten bisher eine Vielzahl von Medizitechnikunternehmen auf einen eher "pragmatischen" Umgang mit GxP Anforderungen zur Validierung ihrer Anwendungssysteme und einen GxP konformen Betrieb, Wartung, Pflege und Stilllegung ihrer Anwendungssysteme, da die Notwendigkeit als zu vernachlässigen eingestuft wurde. Gleichzeitig steht eine Vielzahl der SAP Anwendungsunternehmen aktuell vor der Herausforderung, bis 2025 auf SAP…